Quimica Estrutura dos atomos
30 de agosto de 2022Períodos
Estão organizados em ordem crescente de numero atômico. Cada linha é denominada período.
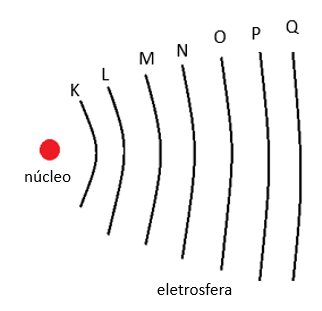
Cada camada da linha da tabela períodica representa um nivel
Cada coluna da tabela perídica é representada pelo nro de valência
do elemento, no elemento neutro.
Família ou grupo
A tabela períodica possui 18 colunas, sequenciais verticais de elementos. Cada uma delas indica um grupo, ou uma família. de elementos. O numero da família indica a quantidade de eletrons na camada de valência.
Observações
- Atomos de elementos de um mesmo período apresenta igual numero de camadas
- A camada mais externa do atomo é envolvida diretamente no estabelecimento de união com outro atomo.
- Os eletrons da camada de valência são chamados de eletrons de valencia.
- Elementos de um mesmo grupo na tabela periodica apresentam o mesmo numero de eletrons na camada de valencia.
Propriedades físicas e químicas
metais:
- Bons condutores de calor e eletricidade
- possuem brilho caracteristico
- alta maleabilidade
- ductilidade
- geralmente possuem alto ponto de fusão e ebulição.
- alta densidade
- sao solidos na CNTP (exceto do Hg)
- Possuem tendencias a formar cations
AMETAIS
- Maus condutor de calor e electricidade
- Geralmente possuem baixo ponto de fusão e ebulição
- Baixa maleabilidade e ductilidade
- aparecem nos 3 estados físico
- Não reagem com ácidos
- Possuem tendência a formar ânodos
Semimetais
Possuem propriedades intermediarias entre dos metais e dos ametais
São sólidos e semicondutores
Gases nobres nas condições ambientes apresenta-se no estado gasosos e sua principal característica química e a grande estabilidade.
Exercício
- Determine a posição do elemento Z=11, na tabela periódica com base na distribuição eletrônica.
Resolução:
1S² 2S² 2p6 3s¹
2) O Elemento S se encontra no terceiro período e pertence ao grupo dos calcogênios (16 ou 6A). Qual a configuração eletrônica de sua camada de valência
Resolução
3 período, logo a camada de valencia é a 3 camada.
1s2 2s2 2p6 3s2 3p4 => M = 6 eletrons
Propriedades periódicas dos elementos
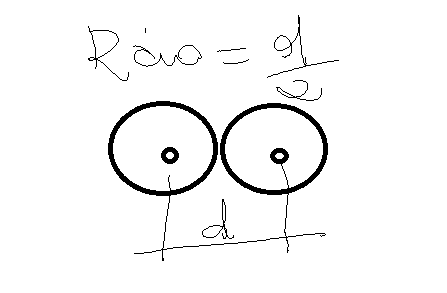
Raio atômico
O Raio atómico será a distancia media do eléctron mais externo até o núcleo
Raio iônico: Esta relacionado com a mudança no tamanho do átomo quando ele perde ou ganha eletrons
O Raio de um cation sempre sera menor do que o raio do seu atomo neutro
O Raio de um anion sempre sera maior do que o raio do seu atomo neutro.
Isoeletronicos
Os Ions
13AL3+ 12Mg2+ 11Na+ 9F-
- Note que ao perder ou ganhar eletrons , todos ficam com 10 eletrons.
- O que predomina é a quantidade de protons, ou seja a carga nuclear.
- Então o raio do alumínio é o menor e o do fluor é o maior
