Tabela Períodica (Continuação aula anterior)
Famílias B
Os elementos dessas famílias são denominados elementos de transição. Uma parte ocupa o bloco central da tabela e são denominados elementos de transição externa. Outra parte deles esta localizada abaixo dos demais elementos, que são os elementos de transição interna. Isso é necessário para evitar o alongamento da tabela periódica.
Sendo assim, na tabela temos os elementos representativos (Família A) e os elementos de transição externa e interna ( FamíliaB)
Os elementos de transição externa vão das famílias 3 a 12 (10 colunas), apresentam seus elétron mais energético em subníveis D.
Todos que terminam em S, P, D ou F possuem um lugar na tabela periódica.
Logo

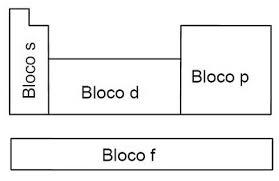
S e P -> São os representativos
D -> elementos de transição externa
F -> Elementos de transição interna.
Com a distribuição eletrônica do átomo de um dado elemento químico, é possível determinar a sua localização na tabela.
Ex
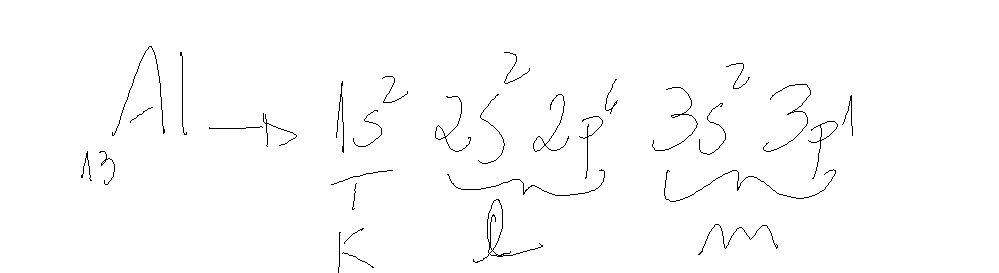
Temos que:
- Três camadas (k, L,M): 3º período
- Três eletrons na camada de valência (3s² 3p¹): F3A
- Eletron de maior energia situado no subnível p (3p¹), bloco p (elemento representativo).
Energia de Ionização
Energia mínima necessária para retirar um eletron de um átomo gasoso.
Obs:
Quanto maior o raio atomico, menor será a atração exercida pelo núcleo sobre o elétron mais afastado.
Vamos ver o caso do alumínio.
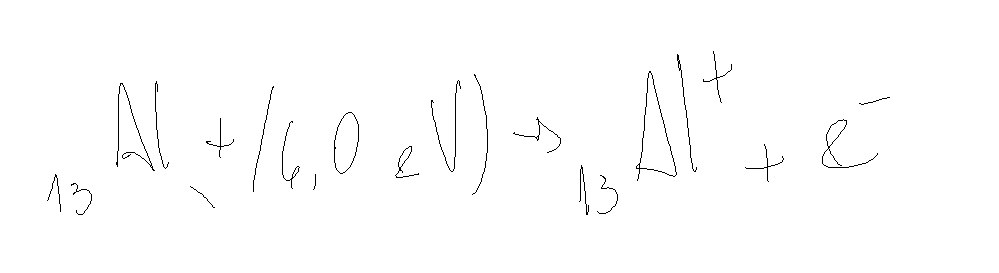
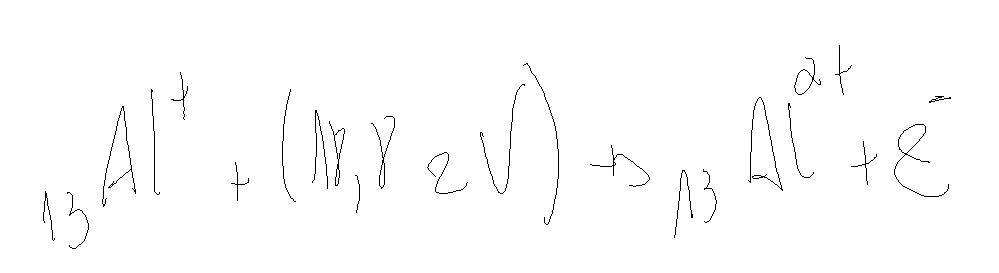
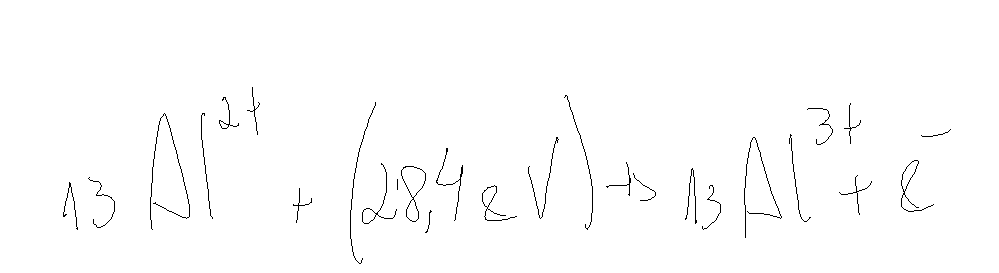
O raio atômico e a energia de ionização são inversamente proporcionais.
Afinidade eletrônica
É a energia mínima liberada ou absorvida quando um átomo neutro, isolado no estado gasoso, recebe um eletron.
Quanto menor for o raio, maior a afinidade eletrônica.
Os ametais possuem alta eletroafinidade, por isso que eles tendem a receber eletrons e formar ânios.
Os metais possuem baixa eletroafinidade, tendem a perder eletrons, formando cátions.
O elemento fluor, por exemplo, tem a capacidade de atrair eletrons, originando um íon de carga negativa. Quando isso ocorre, a energia liberada é de 328KJ.

Eletronegatividade
É a tendência que um átomo possui de atrair eléctron para perto de si, quando se encontra ligado a outro elemento químico diferente por meio de uma ligação covalente.
Quanto menor o tamanho do átomo, maior a força de atração, pois a distancia entre o núcleo e o eletron da ligação será menor.
Ordem decrescente de eletronegatividade
F > O > N> Cl > Br > I > S > C > P > H
Seus respectivos valores.
4,0 > 3,5 > 3,0 >= 3,0 >= 3,0 > 2,8 >= 2,5 >= 2,5 > 2,1.
Eletropositividade
É a tendencia do núcleo do atomo de afastar os eletrons da camada de valencia quando forma um composto.
Desta maneira, é o contrário da eletronegatividade em que o átomo pende a atrair compartilhados em uma ligação.
Reatividade
Os elementos que tendem a doar ou ganhar eletrons são muitos reativos, ou seja, reagem com facilidade. Sendo assim, quanto mais eletropositivo ou eletronegativo mais reativo é esse elemento.
Exercícios
Exercício 1
As configurações electrónicas abaixo correspondem, respectivamente, quais alternativas abaixo>
- I – 1S², 2s² , 2p5
- II – 2s² , 2s², 2p6, 3s², 3p6
- III – 1s², 2s², 2p6, 3s² , 3p6, 4s², 3d5
- 1s², 2s², 2p6, 3p6, 4s², 3d10, 4p6, 5s¹
a) Halógenio, gas nobre, metal de transição interna e metal alcalino terroso.
b) elemento do grupo 15, gas nobre, haloginio e metal alcalino
c) halogenio, calogênio , metal de transição e metal alcalino.
d) halogenio, gas nobre, metal de transição e metal alcalino.
Exercício 2
O raio iônico é o raio de um cation ou de um ânio. Quando um átomo neutro se converte em um íon, espera-se uma mudança no seu tamanho. Em relação ao raio iônico, verifique as seguintes afirmalçoes.
I) O raio do Li+ é menor que o raio do li, pois o primeiro apresenta um elétrons a menos.
II) Os ions Na+ , F- e MG²+ têm a mesma configuração eletronica, porém seus raios deferem porque eles têm diferentes números atomicos.
III) O raio dos ânions é maior que o raio do átomos originais devido ao aumento do número de eletrons na camada de valencia dos anios e aos efeito de repulsão que os eletrons exercem uns sobre outros.
IV) O raio ionico diminui de cima para baixo em um mesmo grupo da tabela períodica devido ao aumento sucessivo do número de camadas eletrônicas.
Quais das alternativas acima estão corretas
Exercício 3
Em m mesmo período da tabela periodica, o aumento do numero atomico é acompanhado pela diminuição do raio atomico. Simultaneamente, há o aumento de todas as seguintes grandezas, exceto.
a) Eletronigatividade
b) carga nuclear
c) energia de ionização
d) numero de níveis electrónicos.
Resposta D
4) As configurações eletrônicas dos elementos E1, E2 e E3 são:
- E1: 1S², 2S², 2p6, 3s¹
- E2: 1s², 2s², 2p6, 3s², 3p5
- E3: 1s², 2s², 2p6, 3s², 3p6, 4s¹
De acordo com tais configurações, a alternantiva correta é
a) O elemento E2 tem maior raio atômico que o elemento E1.
b) O elemento E1 tem maior potencial de ionizaçãoque o elemento E3
c) O elemento E3 tem maior afinidade eletronica que o elemento E2
d) Os elementos E1 e E2 são metais é o elemento E3 é não metal.
