Suporte Universal de Química
Projeto criado para atender necessidade pessoal.

Projeto:
https://grabcad.com/library/chemical-universal-bracket-1
Permite pendurar dispositivos e componentes de química.
Projeto criado para atender necessidade pessoal.

Projeto:
https://grabcad.com/library/chemical-universal-bracket-1
Permite pendurar dispositivos e componentes de química.
A natureza elétrica da matéria.
Os raios catódicos foram descobertos em experimentos de descarga elétricas em gases a baixa pressão.
O elétron e o proton.
Os raios catódicos são fluxos de particulas negativas chamadas eletrons.
O modelo atômico de Thomsom surgiu do reconhecimento da natureza eletrica da máteria e da comprovação de que o atomo nao eh indivisivel.
O proton é uma particula subatomica de massa 1836 vezes maior que o eletron.
Isotopos – muda o nro de neutrons.
Isobaros – massa igual, protons diferentes.
Isotonos – Mesma quantidade de neutros.
Ions – Quando existe diferença entre protons e eletrons.
Anion – Negativo, Catio – Positivo.
Ligações Química (Resumo)
A ligações interatômicas
Apenas os gases nobres (He, Ne, Ar, Kr, Xe, Rn), nas condições ambientes, apresentam átomos estaveis isolados, isto é, não unidos a outros atomos.
A eletrosfera é a parte mais externa dos atómos. E, como o núcleo é muito pequeno, parece razoável considerar que a interação entre os átomos tenha a participação da eletrosfera.
Um átomo estará estavel quando sua última camada possuir 8 eletrons ( ou 2, caso se trate da camada K)
Os átomos de gases nobres tendem a se manter não combinados. Portanto, isso parece indicar que um átomo se estabiliza quando possui uma estratosfera semelhante a de um gás nobre.
3 Tipos de ligação interatômica
Ligação Iônica
Metais tendem a perder eletrons e não metais tendem a receber eletrons. Cátion e ânios assim formados se atraem, estabelecendo ligação iônica.
Tende a perder eletrons
Na+ 1s² 2s² 2p6
Cloro Ametal 1s² 2s² 2p6 3s² 3p5
Tende a receber eletron
Cl- 1s² 2s² 2p6 3s² 3p6
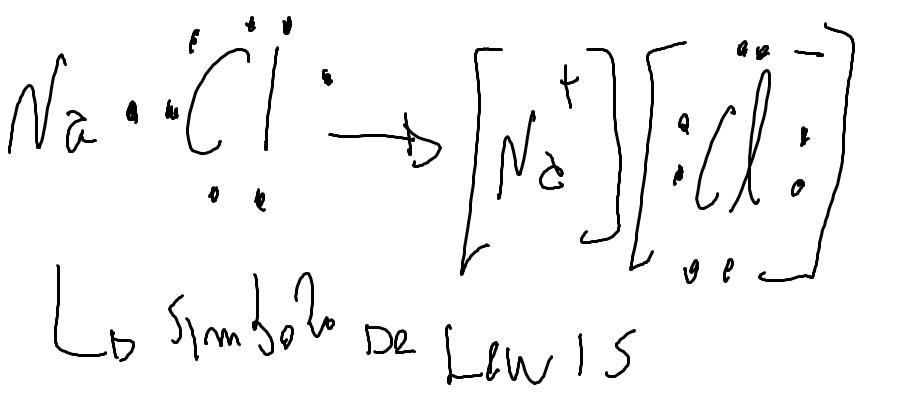
Apresenta os eletrons da camada de valência.
Escrevendo a fórmula do composto iônico
Ao serem escritas as formulas para os compostos ionicos, duas regras podem ser seguidas:
Cloreto de Calcio
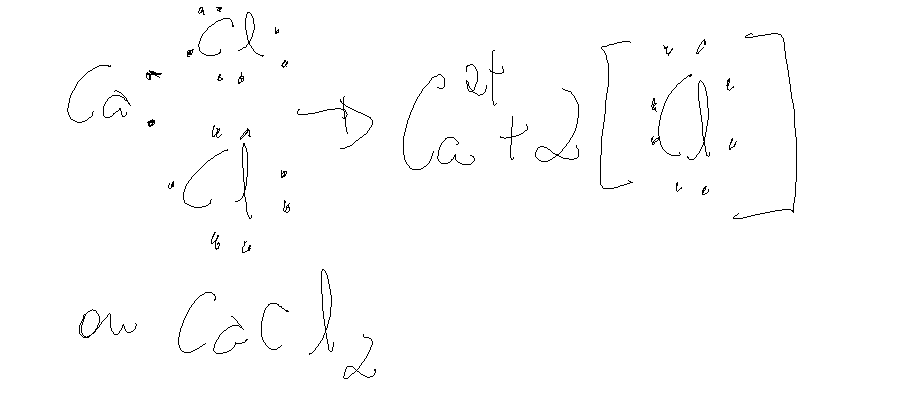
Exemplo
Qual a fórmula do composto Mg e P
Resolução
Para se ter o composto neutro o total de carga negativas e positivas deve ser multiplo de 2+ e 3-, então :
(2+) x 3 = 6+
(3-) x 2 = 6-
Total 0
Sendo assim, a formula do composto será Mg3 P2
Os elementos dessas famílias são denominados elementos de transição. Uma parte ocupa o bloco central da tabela e são denominados elementos de transição externa. Outra parte deles esta localizada abaixo dos demais elementos, que são os elementos de transição interna. Isso é necessário para evitar o alongamento da tabela periódica.
Sendo assim, na tabela temos os elementos representativos (Família A) e os elementos de transição externa e interna ( FamíliaB)
Os elementos de transição externa vão das famílias 3 a 12 (10 colunas), apresentam seus elétron mais energético em subníveis D.
Todos que terminam em S, P, D ou F possuem um lugar na tabela periódica.
Logo

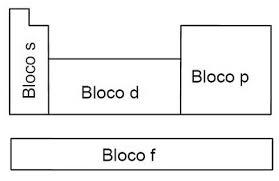
S e P -> São os representativos
D -> elementos de transição externa
F -> Elementos de transição interna.
Com a distribuição eletrônica do átomo de um dado elemento químico, é possível determinar a sua localização na tabela.
Ex
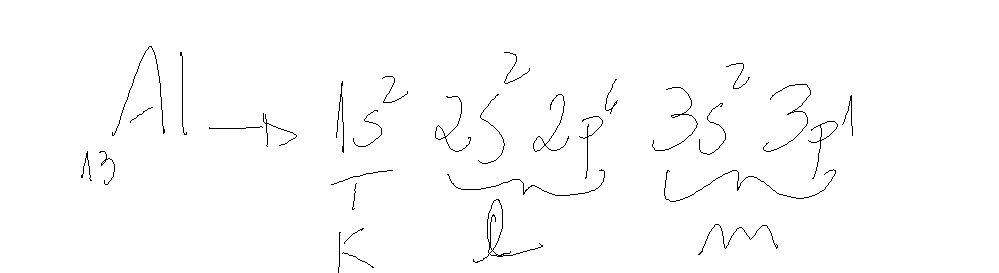
Temos que:
Energia mínima necessária para retirar um eletron de um átomo gasoso.
Obs:
Quanto maior o raio atomico, menor será a atração exercida pelo núcleo sobre o elétron mais afastado.
Vamos ver o caso do alumínio.
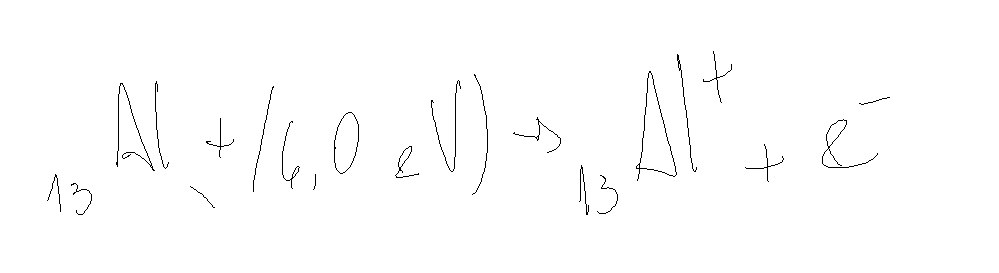
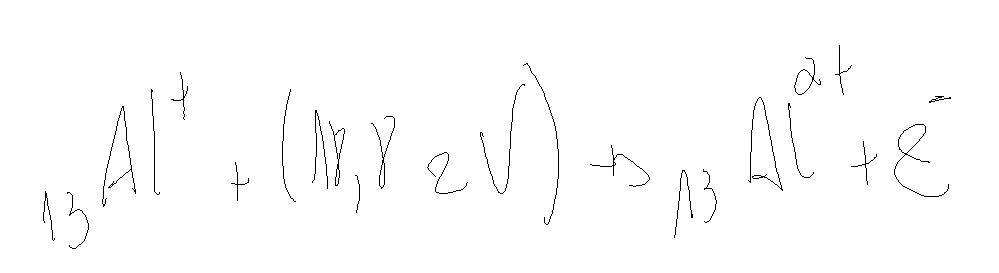
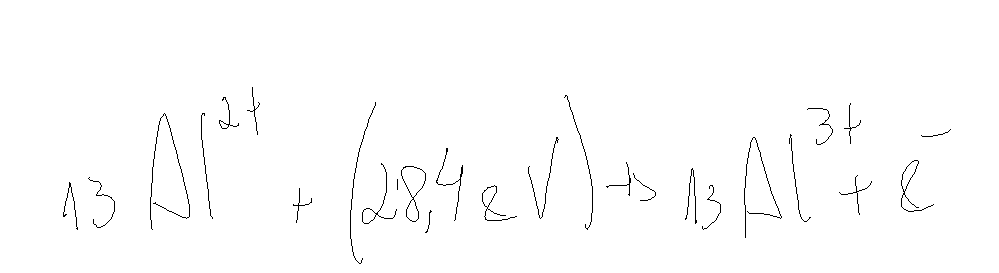
O raio atômico e a energia de ionização são inversamente proporcionais.
É a energia mínima liberada ou absorvida quando um átomo neutro, isolado no estado gasoso, recebe um eletron.
Quanto menor for o raio, maior a afinidade eletrônica.
Os ametais possuem alta eletroafinidade, por isso que eles tendem a receber eletrons e formar ânios.
Os metais possuem baixa eletroafinidade, tendem a perder eletrons, formando cátions.
O elemento fluor, por exemplo, tem a capacidade de atrair eletrons, originando um íon de carga negativa. Quando isso ocorre, a energia liberada é de 328KJ.

É a tendência que um átomo possui de atrair eléctron para perto de si, quando se encontra ligado a outro elemento químico diferente por meio de uma ligação covalente.
Quanto menor o tamanho do átomo, maior a força de atração, pois a distancia entre o núcleo e o eletron da ligação será menor.
Ordem decrescente de eletronegatividade
F > O > N> Cl > Br > I > S > C > P > H
Seus respectivos valores.
4,0 > 3,5 > 3,0 >= 3,0 >= 3,0 > 2,8 >= 2,5 >= 2,5 > 2,1.
É a tendencia do núcleo do atomo de afastar os eletrons da camada de valencia quando forma um composto.
Desta maneira, é o contrário da eletronegatividade em que o átomo pende a atrair compartilhados em uma ligação.
Os elementos que tendem a doar ou ganhar eletrons são muitos reativos, ou seja, reagem com facilidade. Sendo assim, quanto mais eletropositivo ou eletronegativo mais reativo é esse elemento.
As configurações electrónicas abaixo correspondem, respectivamente, quais alternativas abaixo>
a) Halógenio, gas nobre, metal de transição interna e metal alcalino terroso.
b) elemento do grupo 15, gas nobre, haloginio e metal alcalino
c) halogenio, calogênio , metal de transição e metal alcalino.
d) halogenio, gas nobre, metal de transição e metal alcalino.
O raio iônico é o raio de um cation ou de um ânio. Quando um átomo neutro se converte em um íon, espera-se uma mudança no seu tamanho. Em relação ao raio iônico, verifique as seguintes afirmalçoes.
I) O raio do Li+ é menor que o raio do li, pois o primeiro apresenta um elétrons a menos.
II) Os ions Na+ , F- e MG²+ têm a mesma configuração eletronica, porém seus raios deferem porque eles têm diferentes números atomicos.
III) O raio dos ânions é maior que o raio do átomos originais devido ao aumento do número de eletrons na camada de valencia dos anios e aos efeito de repulsão que os eletrons exercem uns sobre outros.
IV) O raio ionico diminui de cima para baixo em um mesmo grupo da tabela períodica devido ao aumento sucessivo do número de camadas eletrônicas.
Quais das alternativas acima estão corretas
Em m mesmo período da tabela periodica, o aumento do numero atomico é acompanhado pela diminuição do raio atomico. Simultaneamente, há o aumento de todas as seguintes grandezas, exceto.
a) Eletronigatividade
b) carga nuclear
c) energia de ionização
d) numero de níveis electrónicos.
Resposta D
4) As configurações eletrônicas dos elementos E1, E2 e E3 são:
De acordo com tais configurações, a alternantiva correta é
a) O elemento E2 tem maior raio atômico que o elemento E1.
b) O elemento E1 tem maior potencial de ionizaçãoque o elemento E3
c) O elemento E3 tem maior afinidade eletronica que o elemento E2
d) Os elementos E1 e E2 são metais é o elemento E3 é não metal.
Estão organizados em ordem crescente de numero atômico. Cada linha é denominada período.
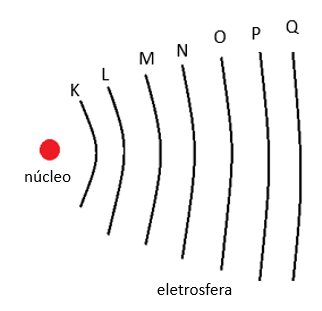
Cada camada da linha da tabela períodica representa um nivel
Cada coluna da tabela perídica é representada pelo nro de valência
do elemento, no elemento neutro.
A tabela períodica possui 18 colunas, sequenciais verticais de elementos. Cada uma delas indica um grupo, ou uma família. de elementos. O numero da família indica a quantidade de eletrons na camada de valência.
Propriedades físicas e químicas
Possuem propriedades intermediarias entre dos metais e dos ametais
São sólidos e semicondutores
Gases nobres nas condições ambientes apresenta-se no estado gasosos e sua principal característica química e a grande estabilidade.
Resolução:
1S² 2S² 2p6 3s¹
2) O Elemento S se encontra no terceiro período e pertence ao grupo dos calcogênios (16 ou 6A). Qual a configuração eletrônica de sua camada de valência
Resolução
3 período, logo a camada de valencia é a 3 camada.
1s2 2s2 2p6 3s2 3p4 => M = 6 eletrons
O Raio atómico será a distancia media do eléctron mais externo até o núcleo
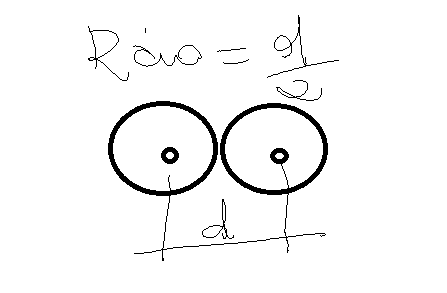
Raio iônico: Esta relacionado com a mudança no tamanho do átomo quando ele perde ou ganha eletrons
O Raio de um cation sempre sera menor do que o raio do seu atomo neutro
O Raio de um anion sempre sera maior do que o raio do seu atomo neutro.
Os Ions
13AL3+ 12Mg2+ 11Na+ 9F-
Em química, camada de valência é a camada que irá realizar as ligações entre os átomos.
A Camada de valência, será a que sempre tiver nível .
Para calcular a camada de valência, utiliza-se o diagrama de Linus Pauling, que demonstra a distribuição eletrônica.
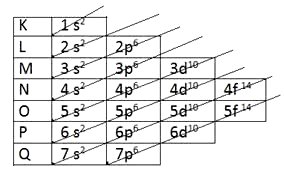
Desta forma, para calcular a camada de valência, aplica-se, de fato a retirada de cada grupo de eletros, conforme seu nível atômico.
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p6
Para encontrar a camada de valência, devemos encontrar o ultimo nível eletrônico.
Quando este estiver eletricamente neutro terá também 31 elétrons.
Ficando sua distribuição, conforme se segue:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p¹ => 2+2+6+2+6+2+10+1=> 31 .
Ficando sua distribuição eletrônica

1s2
2s2 2p6
3s2 3p6 3d10
4s2 4p1
Camada de valência terá 3 elétrons.
2) Com 23 elétrons, ficam

1s2
2s2 2p6
3s2 3p6 3d3
4s2
2 Elétrons na camada de valência (4s2 )
https://www.manualdaquimica.com/quimica-geral/distribuicao-eletronica.htm